
PATROCINADO Y DESARROLLADO POR NOVARTIS
DDx TEMPORADA 4 EPISODIO 3
El futuro de la terapia génica y las enfermedades genéticas
Resumen
Eche un vistazo al futuro de la terapia génica y su capacidad para tratar, quizás eliminar, enfermedades genéticas como el cáncer y la hemofilia. Además, escuche cómo la terapia génica puede estar en la frontera de revertir los efectos del envejecimiento.
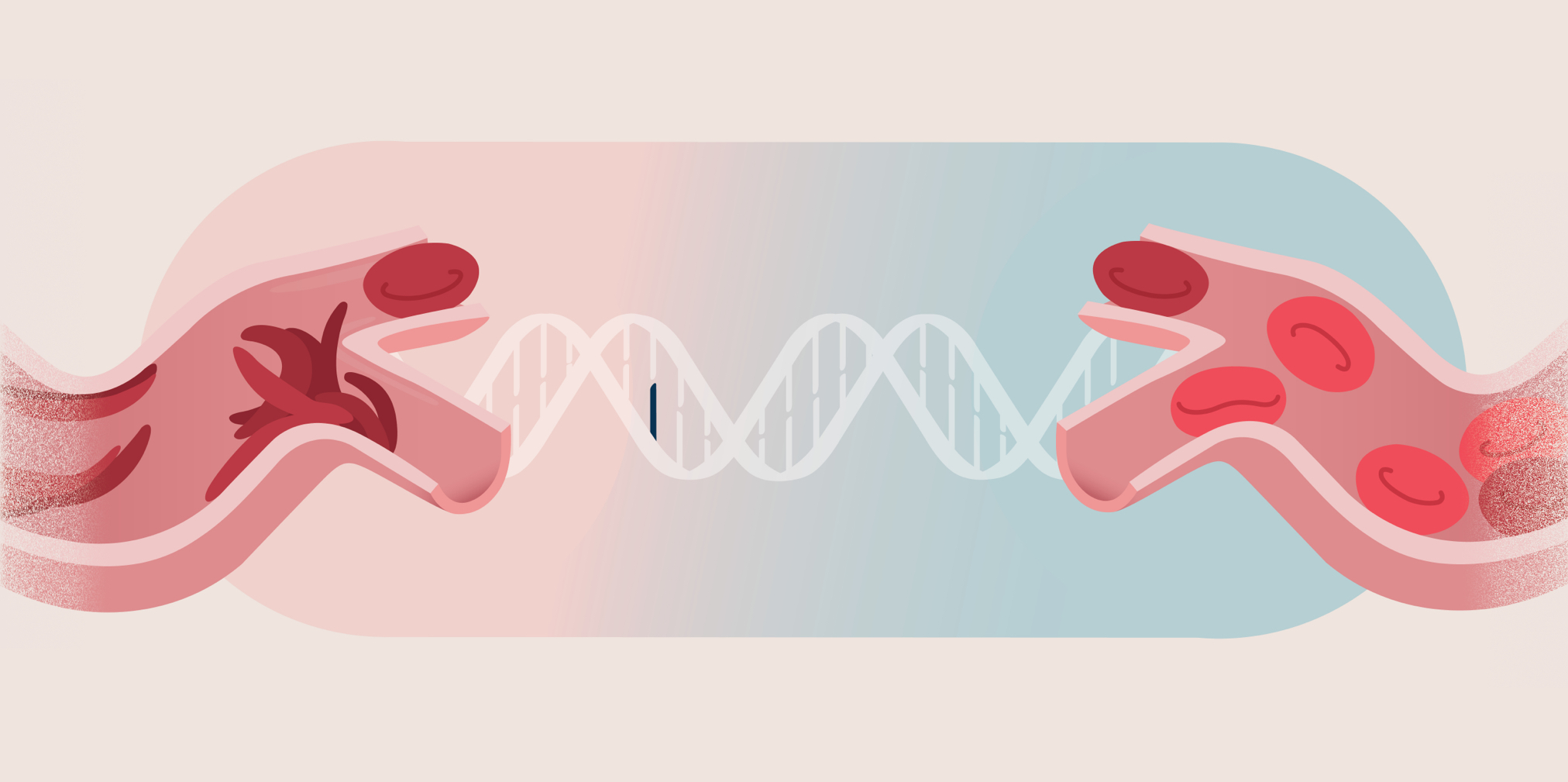
Es un futuro en el que los científicos llevan años trabajando: Cómo tratar problemas de salud complejos con la terapia génica. Y los investigadores han logrado mucho progreso. Los diagnósticos que una vez se pensaron como fatídicos, ahora se analizan desde una nueva perspectiva.
Esto constituye una esperanza para los médicos, cuidadores y, sobre todo, para los pacientes que viven con estas enfermedades genéticas.
Una enfermedad que afecta a las vidas de personas de todo el mundo es el cáncer. Casi el 40 % de la población mundial será diagnosticado con cáncer en alguna etapa de la vida.
Normalmente, el tratamiento contra el cáncer adopta tres formas: quimioterapia, cirugía o terapia de radiación. Las terapias dirigidas con fármacos también existen; su función es identificar y atacar las células cancerígenas individualmente.
Pero el tratamiento que muchos creen que tiene el mayor potencial de cura es la inmunoterapia.
La inmunoterapia se vale del sistema inmunológico de un paciente para atacar y destruir tumores cancerosos. Y una clase específica de inmunoterapia, conocida como terapia de células T con receptores quiméricos de antígeno (Chimeric Antigen Receptor, CAR), es particularmente prometedora.
En los últimos años, se ha acelerado el progreso con esta nueva clase de tratamiento basado en genes.
La terapia con células T con CAR es un tratamiento en el que las propias células inmunitarias de un paciente, los glóbulos blancos llamados células T, se alteran genéticamente para dirigirlas y atacar un cáncer específico dentro del cuerpo. Estas células primero se extraen de la sangre del paciente. Luego, se alteran sus genes para producir proteínas llamadas CAR, que permiten a la célula T reconocer mejor y atacar células cancerígenas específicas. Cuando las células inmunitarias alteradas son reintroducidas en el torrente sanguíneo del paciente, estas proteínas se acoplan tanto a las células sanas como a las cancerosas, destruyen las células cancerosas y dejan ilesas a las células sanas.
La terapia con células T con CAR tiene la capacidad de revolucionar el tratamiento contra el cáncer y prevenir recaídas, ya que estas células tienen el potencial de continuar atacando células cancerosas en el cuerpo de un paciente durante años. Pero no es una solución para todos. Solo alrededor del 40 % de los pacientes tienen respuestas a largo plazo.
Pero si esta terapia logra lo que los científicos creen que puede hacer, la quimioterapia podría ser cosa del pasado, y cuando se trata del futuro de la terapia génica y las enfermedades genéticas, hay motivos para ser optimistas.
Para más información sobre la terapia génica, visite www.genetherapynetwork.com.
Transcripción
DDx TEMPORADA 4 EPISODIO 3
El futuro de la terapia génica y las enfermedades genéticas
RAJ: Esta temporada de DDx es auspiciada por Novartis Gene Therapies.
Apertura
KIM: Helen Obando es una adolescente con dos futuros. En el primer escenario, Helen está luchando por su vida, mientras que en el segundo, la está viviendo.
Nació con anemia de células falciformes.1
Esta enfermedad ocurre cuando la variación de un gen hace que los glóbulos rojos tengan la forma irregular de media luna y queden atrapados en las arterias, lo que causa dolor extremo, así como daño en los órganos y tejidos blandos.1,3
Hasta hace poco, la vida de Helen estaba condicionada por viajes al hospital, episodios insoportables de dolor y la certeza de que probablemente no viviría más allá de los 40 años.2
Anteriormente, la única cura para la anemia de células falciformes era un trasplante de médula ósea. Es un procedimiento doloroso y de alto riesgo, que puede suponer un riesgo de vida si el cuerpo del paciente rechaza el trasplante.1,2.4
Pero ahora, Helen ya no sueña con un futuro sin enfermedades. Sorprendentemente lo está experimentando.1,2
Mostrar introducción
RAJ: Esto es DDx, un podcast de Figure 1 sobre cómo piensan los médicos.
Soy el Dr. Raj Bhardwaj.
Esta temporada me acompaña mi copresentadora, Kim Handysides, para analizar en profundidad la terapia génica.
Hoy hablaremos del futuro de la terapia génica y de su capacidad para tratar, y tal vez incluso dar fin a ciertas enfermedades genéticas.
Comenzaremos por ver cómo se usa la terapia génica para mitigar ciertos cánceres y la hemofilia, y cómo esta terapia está casi a un paso de revertir los efectos del envejecimiento.
Kim lo explicará.
Capítulo 1
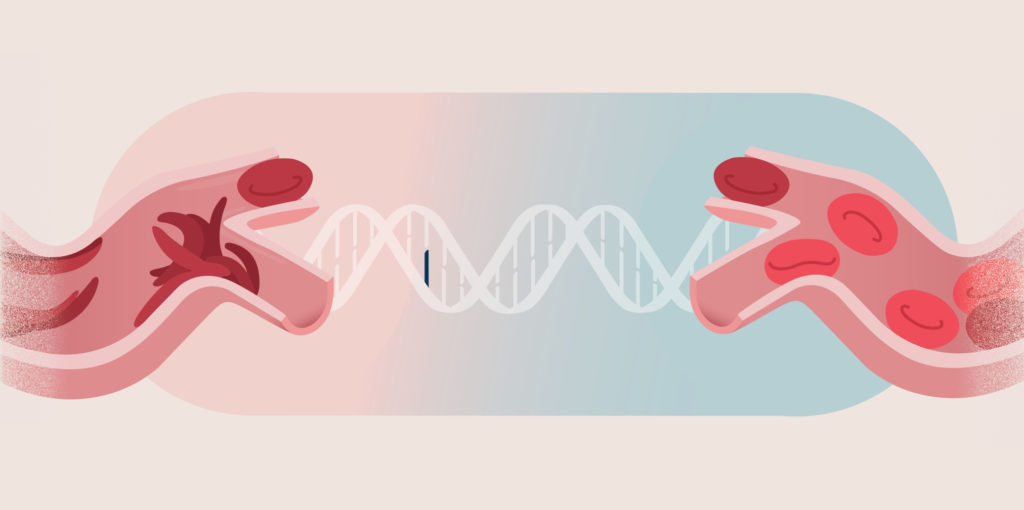
KIM: Es un futuro en pos del cual los científicos han estado trabajando por años: cómo tratar problemas de salud complejos con terapia génica. Y los investigadores han estado progresando. Los diagnósticos que una vez se pensaron como fatídicos, ahora se analizan desde una nueva perspectiva.5
Esto constituye una esperanza para los médicos, cuidadores, y, sobre todo, para los pacientes que viven con estas enfermedades.
Cinco tratamientos de terapia génica ya están aprobados para su uso en los Estados Unidos,6 mientras que cientos de otros son objeto de ensayos de investigación.7
¿Recuerda a Helen Obando? En 2019, fue la primera adolescente estadounidense en ser curada de una anemia de células falciformes mediante terapia génica experimental. Desde entonces, no ha tenido síntomas.2
Y el caso de Helen bien podría ser una demostración del potencial de la terapia génica para tratar también otras enfermedades genéticas.
Empecemos por hablar de una enfermedad que es la principal causa de muerte en todo el mundo: el cáncer.
Casi el 40 % de la población mundial será diagnosticado con cáncer en alguna etapa de la vida.8
Normalmente, el tratamiento contra el cáncer adopta tres formas: quimioterapia, cirugía o terapia de radiación.
Las terapias dirigidas con fármacos también existen; su función es identificar y atacar las células cancerígenas individualmente.9
Pero el tratamiento que muchos creen que tiene el mayor potencial de cura es la inmunoterapia.9
La inmunoterapia se vale del sistema inmunológico de un paciente para atacar y destruir tumores cancerosos.9 Y una clase específica de inmunoterapia, conocida como terapia de células T con receptores quiméricos de antígeno (o CAR), es particularmente prometedora.10
En los últimos años, se ha acelerado el progreso con esta nueva clase de tratamiento basado en genes.9
La terapia con células T con CAR es un tratamiento en el que las propias células inmunitarias de un paciente, los glóbulos blancos llamados células T, se alteran genéticamente para dirigirlas y atacar un cáncer específico dentro del cuerpo. Estas células primero se extraen de la sangre del paciente. Luego, se alteran sus genes para producir proteínas llamadas CAR, que permiten a la célula T reconocer mejor y atacar células cancerígenas específicas. Cuando las células inmunitarias alteradas son reintroducidas en el torrente sanguíneo del paciente, estas proteínas se acoplan tanto a las células sanas como a las cancerosas, destruyen las células cancerosas y dejan ilesas las células sanas.9,10
Es un avance que algunos pacientes adultos con linfoma ya están experimentando.9
La terapia con células T con CAR tiene la capacidad de revolucionar el tratamiento contra el cáncer y prevenir recaídas,11 ya que estas células tienen el potencial de continuar atacando células cancerosas en el cuerpo de un paciente durante años.10 Pero no es una solución para todos. Solo alrededor del 40% de los pacientes demuestran respuestas a largo plazo.10
Pero si esta terapia logra aquello que los científicos creen que puede lograr, la quimioterapia podría ser cosa del pasado.11
La terapia génica también apunta a otra enfermedad: la hemofilia.12
La hemofilia es causada por variaciones en los genes que codifican las proteínas necesarias para la coagulación de sangre.13 En este caso, la terapia génica tiene como objetivo transferir una versión normal del gen a un paciente para restaurar la producción de proteínas de coagulación adecuadas.14
Han pasado más de 30 años desde que el patólogo británico George Brownlee y sus colegas en la Universidad de Oxford identificaron y clonaron por primera vez el gen del factor IX (F9),15 cuya variación puede causar la hemofilia-B.3
Descubrir la variante del gen fue el primer paso. Desde entonces, los científicos han descubierto una forma de transferir ADN corregido a las células del hígado.13
Como el viejo dicho: “regala un pescado a un hombre y le darás alimento para un día, enséñale a pescar y lo alimentarás para el resto de su vida”.
La terapia génica puede enseñar a las células del hígado a producir los factores de la coagulación sanguínea faltantes en personas que sufren de un tipo de hemofilia.14
Sin embargo, la búsqueda de la terapia génica ha sido mucho más ardua en el caso de la hemofilia-A, la forma más común de la enfermedad.16 El desafío aquí es el gen contiguo al gen del factor VIII (F8). Como el F9, el gen F8 también es responsable de producir una proteína para la coagulación.16
Pero a diferencia del F9, el tamaño del F8 es enorme, al menos en comparación con el tamaño habitual de los genes.17
Editar genes no es fácil. Una de las limitaciones es el tamaño del gen que debe ser introducido en las células humanas, a menudo por virus especialmente diseñados y diminutos.18
El gen F8 era demasiado grande para la tecnología original; es como comprar un televisor de gran tamaño y luego darse cuenta de que no cabe en el baúl de su vehículo. Así que los científicos están trabajando en el diseño de un mecanismo de transferencia para genes más grandes, que sería como intercambiar un cinco puertas por una camioneta.17
Y si bien aún hay desafíos por delante,12 hay una gran esperanza para aquellos que viven con hemofilia.19
La terapia génica también se está utilizando para combatir el proceso de envejecimiento en ratones.20
A principios de los 90, una genetista de la Universidad de California en San Francisco, llamada Cynthia Kenyon,21 descubrió algo notable en el código genético de un diminuto gusano conocido como C. elegans. Aisló un gen llamado DAF-2, y notó que una variación en el gen hizo que los gusanos vivieran por más tiempo, a veces el doble de su tiempo de vida normal, que es de unos 20 días.22
Y lo que es más, los gusanos vivían más tiempo porque sus células envejecían más lentamente. El descubrimiento de Kenyon reveló los secretos genéticos del envejecimiento y demostró que la terapia génica tenía el potencial de extender la esperanza de vida de casi cualquier animal.23
Los científicos han identificado más de 300 genes en humanos relacionados con la senescencia celular y el envejecimiento;24 y estos genes son ahora objeto de estudio de una fascinante investigación. Por ejemplo, los científicos en China crearon una nueva terapia génica que puede revertir algunos de los efectos del envejecimiento en los ratones y extender su esperanza de vida.20
El equipo identificó y desactivó un gen llamado KAT-7, que es responsable del envejecimiento celular. Después de 6 a 8 meses, los ratones del estudio mostraron una disminución en los signos biológicos del envejecimiento, y su esperanza de vida había aumentado en un 25 %.20
Existen muchos pasos a realizar antes de que estudios exitosos en animales se conviertan en terapias génicas útiles en humano; pero ahora hay mucho optimismo de que la terapia génica podría prolongar la vida humana al ampliar el vigor de nuestras células también.20 ¿Se imagina un mundo donde todos vivamos para llegar a ser centenarios?
Cierre
KIM: Cuando se trata del futuro de la terapia génica, hay buenos motivos por los cuales ser optimistas.
Hace solo 40 años, la mayoría de las enfermedades genéticas no podían ser tratadas. Han sido vistas como algo permanente de la condición humana. Pero hoy estamos a punto de revolucionar no solo las enfermedades genéticas, sino también el cáncer, e incluso el envejecimiento.
La investigación continuará avanzando de ratones a humanos, y más gente podrá experimentar un futuro sin enfermedades, como Helen Obando.
Mostrar final
RAJ: Un agradecimiento especial al Dr. Peter Kannu, jefe del Departamento de Genética Médica de la Universidad de Alberta y experto en medicina genómica, por compartir su experiencia para la investigación de este episodio.
Esto es DDx, un podcast de Figure 1.
Figure 1 es una aplicación que permite a los médicos compartir imágenes clínicas y conocimiento sobre casos difíciles de diagnosticar.
Soy el Dr. Raj Bhardwaj, copresentador y editor de historias de DDx.
Puede seguirme en Twitter en Raj BhardwajMD.
Diríjase a Figure1.com/ddx, donde puede encontrar las notas completas del programa, fotografías y biografías de los oradores.
Este episodio fue auspiciado por Novartis.
Gracias por escuchar.
Referencias:
- Kolata G. At 16, She’s a Pioneer in the Fight to Cure Sickle Cell Disease. The New York Times. Published January 11, 2020. Accessed November 7, 2021. https://www.nytimes.com/2020/01/11/health/sickle-cell-disease-cure.html
- Kolata G. Pioneering Gene Therapy Freed Her of Sickle Cell. Is a Cure at Hand? The New York Times. Published September 14, 2021. Accessed November 7, 2021. https://www.nytimes.com/2021/09/14/health/sickle-cell-cure.html
- Prakash V, Moore M, Yáñez-Muñoz RJ. Current Progress in Therapeutic Gene Editing for Monogenic Diseases. Mol Ther. 2016;24(3):465-474.
- Inusa BPD, Hsu LL, Kohli N, et al. Sickle Cell Disease-Genetics, Pathophysiology, Clinical Presentation and Treatment. Int J Neonatal Screen. 2019;5(2):20.
- Wang Y, Hu L-F, Zhou T-J, et al. Gene therapy strategies for rare monogenic disorders with nuclear or mitochondrial gene mutations. Biomat. 2021;277:121108.
- Petrich J, Marchese D, Jenkins C, et al. Gene Replacement Therapy: A Primer for the Health-system Pharmacist. J Pharm Pract. 33(6):846-855.
- Is gene therapy available to treat my disorder?MedlinePlus Genetics. NIH. Accessed November 7, 2021. https://medlineplus.gov/genetics/understanding/therapy/availability/
- Cancer Statistics. National Cancer Institute. Accessed November 5, 2021. https://www.cancer.gov/about-cancer/understanding/statistics
- CAR T Cells: Engineering Patients’ Immune Cells to Treat Their Cancers. National Cancer Institute. Accessed November 7, 2021. https://www.cancer.gov/about-cancer/treatment/research/car-t-cells
- CAR T-Cell Therapy, a Breakthrough Treatment for Cancer Patients. Health Matters. Accessed November 8, 2021. https://healthmatters.nyp.org/car-t-cell-therapy-a-breakthrough-treatment-for-cancer-patients/amp/
- Sterner RC, Sterner RM. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer J. 2021;11(4):69.
- Batty P, Lillicrap D. Hemophilia Gene Therapy: Approaching the First Licensed Product. Hemasphere. 2021;5(3):e540.
- High KA. Gene therapy for hemophilia: the clot thickens. Hum Gene Ther. 2014;25(11):915-922
- Hemophilia. American Society of Gene & Cell Therapy. Accessed November 8, 2021. https://patienteducation.asgct.org/disease-treatments/hemophilia
- Cowan H. The scientist behind the treatment of haemophilia B. Reader’s Digest. Accessed November 8, 2021. https://www.readersdigest.co.uk/health/health-conditions/the-scientist-behind-the-treatment-of-haemophilia-b
- Hemophilia. MedlinePlus Genetics. NIH. Accessed November 7, 2021. https://medlineplus.gov/genetics/condition/hemophilia/
- Doshi BS, Arruda VR. Gene therapy for hemophilia: what does the future hold?. Ther Adv Hematol. 2018;9(9):273-293.
- Powell SK, Rivera-Soto R, Gray SJ. Viral expression cassette elements to enhance transgene target specificity and expression in gene therapy. Discov Med. 2015;19(102):49-57.
- Schutgens R. Gene Therapy in Hemophilia: From Hype to Hope. Hemasphere. 2018;2(2):e37
- Pollard MQ. Chinese scientists develop gene therapy which could delay ageing. Reuters. Published January 19, 2021. Accessed November 7, 2021. https://www.reuters.com/article/us-china-genes-ageing-idUSKBN29P02V
- Cynthia Kenyon, PhD. UCSF Profiles. Accessed November 8, 2021. https://profiles.ucsf.edu/cynthia.kenyon
- Kenyon C, Chang J, Gensch E, et al. A C. elegans mutant that lives twice as long as wild type. Nature. 1993;366(6454):461-464.
- Can Kenyon’s Roundworms Lead Us to the Fountain of Youth? University of California San Francisco. Published July 7, 2006. Accessed November 7, 2021. https://www.ucsf.edu/news/2006/07/102096/can-kenyons-roundworms-lead-us-fountain-youth
- GenAge. Human Ageing Genomic Resources. Accessed November 8, 2021. https://genomics.senescence.info/